von Annika
Kaum eine Diagnose trifft so tief ins Innere wie die von Alzheimer. Sie weckt Angst vor dem Vergessen, vor dem Verlust der eigenen Geschichte, der Sprache, der Orientierung. Und doch ist sie für Millionen Menschen weltweit bittere Realität – und für noch mehr eine stille Sorge. Denn Alzheimer betrifft nicht nur einzelne, sondern ganze Familien, ganze Gesellschaften. Wer verstehen will, warum die Forschung zu dieser Krankheit von so zentraler Bedeutung ist, muss begreifen, wie weitreichend ihre Folgen sind.
Warum Alzheimer uns alle betrifft
Alzheimer ist die häufigste Form der Demenz. Die Erkrankung führt zu einem fortschreitenden und irreversiblen Verlust kognitiver Fähigkeiten: Gedächtnis, Sprache, Orientierung und Entscheidungsfindung werden nach und nach beeinträchtigt. Im Verlauf sind Betroffene schließlich auf umfassende Unterstützung und Pflege angewiesen – oft über viele Jahre hinweg. Laut der Weltgesundheitsorganisation (WHO) leben aktuell rund 57 Millionen Menschen weltweit mit Demenz, wobei etwa 60 bis 70 Prozent der Fälle auf Alzheimer entfallen. Sie ist derzeit eine der Hauptursachen für Behinderungen und Pflegebedürftigkeit bei älteren Menschen weltweit. Prognosen gehen davon aus, dass sich die Zahl der Demenzkranken bis 2050 auf etwa 139 Millionen erhöhen wird. In Deutschland sind derzeit etwa 1,2 Millionen Menschen an Demenz erkrankt, die Mehrheit davon an Alzheimer. Mit der Alterung der Bevölkerung wird auch bei uns diese Zahl weiter steigen. Die Deutsche Alzheimer Gesellschaft geht im Jahr 2050 von etwa 2,4 Millionen Erkrankten aus.
Die gesellschaftlichen und wirtschaftlichen Belastungen sind enorm. In Deutschland entstehen durch Demenz jährlich Kosten von geschätzt über 40 Milliarden Euro – Tendenz steigend. Diese Summe umfasst direkte Behandlungskosten ebenso wie Pflegeleistungen und informelle Betreuung durch Angehörige. Ähnliche Entwicklungen zeigen sich auch international: In den USA beliefen sich die jährlichen Gesundheitskosten im Zusammenhang mit Alzheimer 2022 bereits auf 321 Milliarden US-Dollar, mit erwarteten Steigerungen auf über 1 Billion US-Dollar bis 2050.
Doch die finanziellen Dimensionen erzählen nur einen Teil der Geschichte. Alzheimer ist auch eine enorme emotionale Belastung – für die Erkrankten und für ihre Familien. Besonders die pflegenden Angehörigen sind oft über Jahre hinweg großen psychischen und physischen Belastungen ausgesetzt. Studien zeigen, dass sie häufiger an Stress, Depressionen und sozialer Isolation leiden, insbesondere wenn sie die Pflege mit Beruf und eigenen familiären Verpflichtungen vereinbaren müssen. Unterstützungsangebote wie Beratungsstellen oder Selbsthilfegruppen – etwa organisiert durch die Deutsche Alzheimer Gesellschaft– können helfen, die Last etwas zu lindern und Strategien für den Umgang mit dieser Herausforderung zu vermitteln, dennoch schreitet die Erkrankung langsam aber stetig immer weiter voran.
Alzheimer ist damit weit mehr als eine Krankheit des Alters. Es ist ein gesellschaftliches Thema, das uns alle betrifft – in den Gesundheitssystemen, in den Familien und in unserer Verantwortung, Menschen mit Demenz ein Leben in Würde und Teilhabe zu ermöglichen. Gleichzeitig macht die enorme Last, die diese Erkrankung erzeugt, deutlich, wie dringend wir neue Wege in der Diagnose, der Therapie und vielleicht eines Tages auch in der Prävention brauchen.
Die große Suche
Als Alois Alzheimer im Jahr 1906 auf einer Fachkonferenz erstmals den rätselhaften geistigen Verfall seiner Patientin Auguste Deter beschrieb, war noch kaum absehbar, welche Dimension seine Entdeckung einmal annehmen würde. Die winzigen Veränderungen, die er damals im Gehirn beobachtete – später bekannt als Amyloid-Plaques und Neurofibrillen – waren der erste Schritt auf einer langen und bis heute andauernden Suche nach den Ursachen einer der größten Herausforderungen der modernen Medizin. In den über 100 Jahren seit dieser Erstbeschreibung hat sich die Alzheimer-Forschung in atemberaubendem Tempo entwickelt. Heute reicht die Suche von der molekularen Ebene einzelner Proteine bis zu großen internationalen Bevölkerungsstudien.
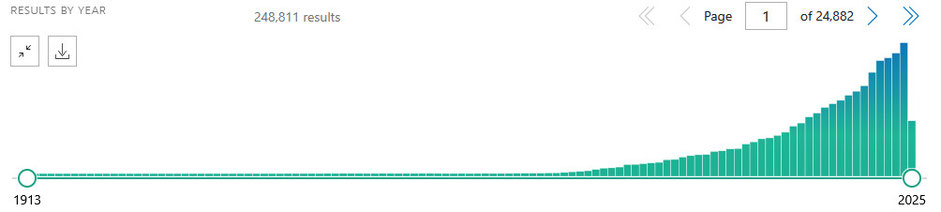
Ein Blick auf die medizinische Literatur zeigt, wie gewaltig dieses Forschungsfeld inzwischen ist. Gibt man heute bei PubMed (eine bibliographische Datenbank der National Library of Medicine) nur den Begriff „Alzheimer“ ein, erscheinen mehr als 248.000 wissenschaftliche Veröffentlichungen – eine Zahl, die eindrücklich verdeutlicht, wie viele verschiedene Aspekte dieser Krankheit inzwischen untersucht werden. Die folgende Abbildung veranschaulicht diese Entwicklung deutlich. Man sieht, dass die Zahl der Publikationen bis in die 1980er Jahre hinein relativ gering war, dann jedoch ein deutlicher Anstieg einsetzte, der bis heute anhält.
Ein wichtiger Wendepunkt war die Entdeckung, dass sich bei Alzheimer-Patient:innen charakteristische Ablagerungen aus Beta-Amyloid-Proteinen im Gehirn bilden – ein Befund, der Anfang der 1980er Jahre große Aufmerksamkeit erregte. Mit dieser Entdeckung gewann die Suche nach molekularen Mechanismen deutlich an Fahrt. Seither hat sich die Forschung in viele Richtungen entfaltet, doch trotz aller Fortschritte blieben die großen Fragen lange offen: Warum beginnt Alzheimer? Was löst die ersten Veränderungen aus? Und warum verlaufen Krankheitsprozesse so unterschiedlich von Mensch zu Mensch?
In den vergangenen Jahrzehnten wurden verschiedene Hypothesen entwickelt, immer weiter verfeinert und schließlich vernetzt. Heute wissen wir, dass Alzheimer kein linearer Prozess ist, sondern ein Zusammenspiel vieler Faktoren. Gerade diese Komplexität hat die Suche nach den entscheidenden Mechanismen und wirksamen Therapien immer wieder erschwert und begleitet die Forschung bis heute.
Die Geschichte der Alzheimer-Forschung ist damit nicht nur eine Geschichte von Entdeckungen, sondern auch von Enttäuschungen, Umwegen und immer neuen Anläufen. Jede Hypothese, jeder neue Biomarker, jede klinische Studie ist Teil eines großen Puzzles, das noch nicht vollständig zusammengesetzt ist. So geht die große Suche weiter – mit unverminderter Energie und einem Ziel, das nicht nur wissenschaftlich, sondern zutiefst menschlich ist: Alzheimer besser zu verstehen und eines Tages wirksam zu heilen.
Zwei Wege der Forschung
Die Alzheimer-Forschung folgt heute zwei großen, eng miteinander verknüpften Pfaden. Zum einen geht es darum, die biologischen Ursachen der Erkrankung besser zu verstehen, zum anderen darum, wirksame Strategien zur Früherkennung, Behandlung oder Vorbeugung zu entwickeln. Beide Richtungen bedingen einander: Nur wer die Mechanismen kennt, kann gezielt intervenieren und nur durch therapeutische Studien lässt sich überprüfen, ob unser Verständnis der Krankheit wirklich trägt. Daber bauen diese zielgerichteten Forschungsbemühungen auf einen dritten, oft unsichtbaren Akteur: die Grundlagenforschung. Sie ist nicht auf kurzfristige Anwendung ausgerichtet, sondern stellt Fragen, entwickelt Methoden und untersucht Phänomene zunächst ohne konkreten Bezug zur Diagnose oder Therapie. Und doch entsteht genau hier das Fundament für spätere Durchbrüche, sei es in Form neuer Messverfahren, unerwarteter Zusammenhänge oder grundlegender Denkmodelle. Im Folgenden wollen wir uns nun aber den beiden Hauptsträngen der heutigen Alzheimerforschung widmen – der Suche nach den Ursachen der Krankheit und der Entwicklung von Ansätzen, um ihr klinisch zu begegnen.
1. Ursachenforschung: Den Ursprung der Krankheit entschlüsseln
Alzheimer ist eine Krankheit mit vielen Gesichtern – und mit vielen Ursachen. In den letzten Jahrzehnten hat sich unser Verständnis ihrer Entstehung deutlich erweitert. Heute wissen wir: Es gibt nicht den einen Auslöser, sondern ein komplexes Zusammenspiel zahlreicher biologischer Prozesse, die sich über Jahre hinweg aufschaukeln und gegenseitig verstärken.
Im Zentrum standen lange Zeit Ablagerungen von Amyloid-β-Proteinen, die im Gehirn verklumpen und die für Alzheimer typischen Plaques bilden. Diese Ablagerungen gelten als Startpunkt einer schädlichen Kaskade: Sie lösen Entzündungen aus, stören die Kommunikation zwischen Nervenzellen und führen letztlich zu ihrem Absterben. Doch das allein reicht nicht aus, um den Krankheitsverlauf zu erklären. Mindestens ebenso bedeutend ist das sogenannte Tau-Protein, das sich bei Alzheimer ebenfalls pathologisch verändert und verklumpt. Diese neurofibrillären Bündel korrelieren enger mit dem Schweregrad der Symptome als die Amyloid-Plaques.
Zunehmend rücken auch andere Mechanismen in den Fokus. Oxidativer Stress etwa – ein Übermaß an aggressiven Sauerstoffverbindungen – schädigt Eiweiße, Fette und DNA und führt zu Funktionsverlust in Nervenzellen. Die Mitochondrien, als Energieproduzenten der Zellen, sind dabei besonders betroffen: Ihre Fehlfunktion fördert die Entstehung freier Radikale und beschleunigt den zellulären Verfall. Auch das Immunsystem des Gehirns spielt eine Rolle. Mikrogliazellen, die normalerweise schädliche Substanzen beseitigen, können bei chronischer Aktivierung selbst zum Problem werden – sie greifen gesunde Nervenzellen an und verschärfen die neurodegenerativen Prozesse.
Neben diesen zellulären Faktoren sind auch Durchblutungsstörungen, Störungen im Fettstoffwechsel und eine veränderte Zusammensetzung der Darmflora Teil des Krankheitsgeschehens. Gefäßerkrankungen beeinträchtigen die "Müllentsorgung" des Gehirns, während ein gestörter Cholesterinhaushalt strukturelle Zellschäden begünstigen kann. Und die sogenannte Darm-Hirn-Achse wird inzwischen als eigenständiger Kommunikationsweg betrachtet, über den Entzündungsprozesse und bakterielle Produkte das Gehirn beeinflussen können.
Ein entscheidender – und lange unterschätzter – Faktor sind genetische Veranlagungen. Schätzungen zufolge lassen sich 60–80 % des Erkrankungsrisikos auf erbliche Faktoren zurückführen. Während seltene, hochwirksame Mutationen in Genen wie APP, PSEN1 oder PSEN2 vor allem bei früh auftretendem Alzheimer eine Rolle spielen, tragen beim weitaus häufigeren Spätbeginn viele verschiedene Genvarianten mit kleinen Effekten zum Risiko bei. Besonders bedeutsam ist dabei das APOE-Gen: Träger der ε4-Variante haben ein erhöhtes Erkrankungsrisiko, während ε2 sogar einen gewissen Schutz zu bieten scheint. Doch das Bild ist komplexer: Viele weitere Gene – über 70 Risikoloci wurden bislang identifiziert – beeinflussen immunologische, metabolische oder lipidbezogene Prozesse. Und die genetischen Risikoprofile unterscheiden sich je nach ethnischer Herkunft erheblich, was gezielte Präventionsstrategien erschwert.
All diese Prozesse – Proteinfehlfaltungen, oxidative Schädigung, Energiekrisen in den Zellen, Immunfehlregulation, vaskuläre Faktoren und genetische Disposition – wirken nicht isoliert, sondern greifen ineinander. Gemeinsam führen sie zu einem Prozess, der das eigentliche Krankheitsbild von Alzheimer prägt: die fortschreitende Neurodegeneration. Sie beginnt häufig im Hippocampus, der für Gedächtnisbildung zuständig ist, und breitet sich im Verlauf auf andere Hirnregionen aus. Nervenzellen verlieren zunächst ihre Synapsen – also die Kontaktstellen, an denen Informationen weitergegeben werden – und sterben schließlich ganz ab. Gleichzeitig kommt es zu einer chronischen Aktivierung von Immunzellen im Gehirn (Mikroglia), zu Entzündungsreaktionen und zu Umbauprozessen. Das Gehirn schrumpft sichtbar. Die folgende Abbildung veranschaulicht diesen vielschichtigen Prozess eindrücklich: Während ein gesundes Gehirn durch stabile Zellstrukturen und funktionierende Kommunikation zwischen Nervenzellen geprägt ist, zeigen sich im erkrankten Gehirn typische Veränderungen wie Amyloidplaques, neurofibrilläre Tau-Ablagerungen, Synapsenverlust, Immunüberreaktion und fortschreitende Atrophie. Diese neurobiologischen Veränderungen sind es, die letztlich zu den Symptomen führen, die im Alltag sichtbar werden – dem schleichenden Verlust von Gedächtnis, Orientierung, Sprache und Urteilsvermögen.
All diese Erkenntnisse verdeutlichen: Die Ursachen von Alzheimer bilden ein vielschichtiges Puzzle. Proteinfehlfaltungen, oxidative Schädigung, Energiekrisen in den Zellen, Immunfehlregulation, vaskuläre Faktoren, Stoffwechselentgleisungen und genetische Dispositionen wirken zusammen – oft verstärkt durch Umweltfaktoren und Lebensstil. Wer heute an Alzheimer forscht, folgt keinem linearen Pfad mehr, sondern kartiert ein komplexes Netzwerk biologischer Wechselwirkungen. Dieses wachsende Verständnis der Krankheitsmechanismen bildet die Grundlage für neue Diagnoseverfahren und Therapien, mit denen Alzheimer künftig früher erkannt und gezielter behandelt werden kann.
2. Therapie- und Diagnostikforschung: Alzheimer früher erkennen und besser behandeln
Alzheimer kann bislang nicht geheilt werden. Dennoch gibt es heute eine Reihe an Behandlungs- und Betreuungsmöglichkeiten, die den Verlauf der Erkrankung verzögern, Symptome lindern und die
Lebensqualität der Betroffenen verbessern können. In der medizinischen Praxis kommen vor allem sogenannte Acetylcholinesterase-Hemmer wie Donepezil, Rivastigmin oder Galantamin zum Einsatz. Diese Medikamente wirken nicht
ursächlich, sondern symptomatisch: Sie erhöhen die Konzentration von Botenstoffen im Gehirn, um vorübergehend die geistige Leistungsfähigkeit zu stützen. Ergänzt wird die Behandlung durch
nicht-medikamentöse Angebote wie Gedächtnistraining, Bewegungstherapie, Ergotherapie, Musik oder künstlerische Aktivierung – sie helfen, vorhandene Fähigkeiten zu erhalten, Tagesstruktur zu schaffen und Selbstwirksamkeit zu fördern.
Die Diagnose erfolgt heute meist über Gespräche, neuropsychologische Tests, bildgebende Verfahren wie die Magnetresonanztomographie (MRT) und in spezialisierten Zentren über die Analyse der
Rückenmarksflüssigkeit (Liquor). Diese Verfahren greifen jedoch meist erst dann, wenn bereits strukturelle Schäden im Gehirn messbar sind – also in einem Stadium, in dem erste Symptome meist
schon deutlich wahrnehmbar sind. Im MRT sichtbare Veränderungen deuten auf einen fortgeschrittenen Prozess hin, nicht auf einen Frühbefund. Das bedeutet: Viele Menschen erhalten ihre Diagnose
spät – oft zu spät, um neue krankheitsmodifizierende Therapien noch wirksam einsetzen zu können.
Genau hier setzen viele aktuelle Forschungsansätze an. Alzheimer früher, einfacher und sicherer zu erkennen – das ist ein zentrales Ziel. Besonders intensiv wird an Biomarkern geforscht, die
bestimmte Eiweißveränderungen zum Beispiel im Blut nachweisen können, etwa Beta-Synuclein, phosphoryliertes Tau oder sogenannte Neurofilamente. Erste Studien zeigen vielversprechende Ergebnisse mit hoher
diagnostischer Genauigkeit – teilweise vergleichbar mit deutlich aufwendigeren und unangenehmeren Liquortests. Der große Vorteil: Ein einfacher Bluttest ließe sich im Prinzip auch in der
hausärztlichen Versorgung durchführen. Doch noch ist es nicht so weit: Die Verfahren sind derzeit nur in Studien oder an spezialisierten Zentren im Einsatz, standardisierte Grenzwerte und breite
Anwendungsrichtlinien fehlen bislang.
Ein weiterer Fokus liegt auf neuen Medikamenten, die nicht nur Symptome lindern, sondern direkt in den Krankheitsverlauf eingreifen sollen. Besonders im Gespräch sind dabei monoklonale Antikörper wie Lecanemab oder Donanemab, die sich gegen Amyloidablagerungen
im Gehirn richten. Studien deuten darauf hin, dass eine Behandlung mit diesen Antikörpern im sehr frühen Krankheitsstadium den geistigen Abbau etwas verlangsamen können. Gleichzeitig sind sie mit
hohen Kosten, teils gravierenden Nebenwirkungen und einem aufwendigen Diagnoseverfahren verbunden – denn die Amyloidbelastung muss zuvor eindeutig nachgewiesen werden, etwa über PET oder
Liquoranalyse. Der Nutzen dieser Therapien muss daher individuell sorgfältig abgewogen werden.
Neben diesen medikamentösen Entwicklungen werden auch neue Therapiepfade erkundet. Die Nanomedizin etwa erforscht, wie sich Medikamente mithilfe winziger Transportvehikel gezielt an ihren Wirkort im Gehirn bringen lassen.
Diese Transporter könnten nicht nur dabei helfen, die Blut-Hirn-Schranke zu überwinden, sondern auch die Dosierung optimieren und Nebenwirkungen minimieren. Erste präklinische Studien zeigen, dass sich mit
nanobasierten Trägersystemen sowohl klassische Wirkstoffe als auch neue experimentelle Substanzen effizienter und präziser verabreichen lassen. Auch diagnostische Verfahren könnten davon
profitieren, etwa durch die Entwicklung von nanogestützten Kontrastmitteln für die Bildgebung. Noch steckt diese Forschung in den Kinderschuhen, aber das Potenzial ist groß – insbesondere im
Hinblick auf individualisierte, verträglichere Alzheimer-Therapien der Zukunft.
Auch die personalisierte Medizin
gewinnt zunehmend an Bedeutung. Künftig könnte es möglich sein, Alzheimer nicht nur früher, sondern auch gezielter zu behandeln – angepasst an das genetische Profil, individuelle Risikofaktoren,
Begleiterkrankungen und sogar Lebensstilmerkmale. Dabei spielen moderne Datenanalysen eine Schlüsselrolle: Mithilfe künstlicher Intelligenz werden bereits heute komplexe Muster in großen
medizinischen Datenmengen erkannt, die Hinweise auf Krankheitsverläufe und Therapieansprechen geben können. Ziel ist es, für jede betroffene Person den optimalen Zeitpunkt, das passende
Medikament und die wirksamste Strategie zu finden, bevor der Schaden im Gehirn zu groß ist.
So bewegt sich die Alzheimerforschung auf vielen Ebenen voran: von der Früherkennung über neue Therapieformen bis hin zu einem besseren Verständnis des individuellen Verlaufs. Noch ist vieles
davon Zukunftsmusik. Aber schon heute zeichnet sich ab, dass der Umgang mit Alzheimer differenzierter und präziser wird.
Alzheimer im Wandel der Zeit
Eine Alzheimer-Diagnose vor dreißig Jahren war ein Wendepunkt – meist nach Jahren der Unsicherheit gestellt, oft erst im fortgeschrittenen Stadium, und begleitet von Hilflosigkeit. Es gab kaum
Therapien, keine Frühdiagnostik, und das Wissen über die Krankheit war fragmentarisch. Viele Betroffene fühlten sich entmündigt statt aufgefangen, und für Angehörige war die Belastung enorm –
nicht nur emotional, sondern auch organisatorisch und gesellschaftlich. Einmal ausgesprochen, galt „Alzheimer“ wie ein geistiges Todesurteil.
Heute ist diese Diagnose immer noch schwer, aber sie bedeutet nicht mehr dasselbe. Immer häufiger wird Alzheimer früher erkannt, differenzierter eingeordnet und aktiver begleitet. Die Forschung
hat nicht nur neue Medikamente hervorgebracht, sondern auch einen Perspektivwechsel: Statt nur den Niedergang zu beobachten, geht es darum, Ressourcen zu stärken, Verläufe zu verstehen und
frühzeitig gegenzusteuern. Das erfordert Wissen, aber auch Strukturen – und beides wächst.
Was aber wird eine Alzheimer-Diagnose in dreißig Jahren bedeuten? Vielleicht wird sie dann nicht mehr primär mit Kontrollverlust, sondern mit Handlungsspielraum verbunden sein. Mit einem präzisen
Biomarkerprofil, das individuelle Risiken aufzeigt. Mit personalisierten Behandlungsplänen, die Entzündungen modulieren, synaptische Funktionen stützen oder Lebensstil gezielt einbeziehen. Mit
digitalen Assistenten, die Veränderungen früh erkennen und Betreuung koordinieren. Und mit einer Versorgung, die auf Beteiligung, nicht auf Ausgrenzung setzt. Ein zentraler Unterschied wird
vermutlich schon in der Art liegen, wie wir zu dieser Diagnose kommen: Nicht mehr durch sichtbare Hirnschäden im MRT, sondern durch feine biologische Signale im Blut – lange bevor das Gedächtnis
nachlässt. Dieser zeitliche Vorsprung ist entscheidend: Je früher erkannt wird, was sich verändert, desto gezielter lässt sich gegensteuern. Die Werkzeuge dafür entstehen jetzt.
Der Weg dorthin ist aber kein Automatismus. Er braucht Forschung, politische Entscheidungen und gesellschaftlichen Willen. Aber er ist machbar. Und er führt uns in eine Zukunft, in der Alzheimer
seinen Schrecken verliert, weil wir wissen, wie wir damit umgehen können. Dieses Wissen entsteht mit jeder Studie, jeder klinischen Erfahrung und jedem offenen Gespräch darüber.
Hinweis:
Die Alzheimerforschung ist ein dynamisches und äußerst komplexes Feld. Dieser Artikel kann und will nicht alle Facetten vollständig abbilden. Er versteht sich
als fundierte Übersicht und Einladung zur weiteren Auseinandersetzung, nicht als abschließende Darstellung. Für Anregungen, Rückfragen oder Ergänzungen bin ich jederzeit offen – ich freue mich
über Austausch.
Quellen (im Text sind alle Studien oder Übersichtsartikel an passender Stelle auch direkt verlinkt)
- Andrade-Guerrero J, Santiago-Balmaseda A, Jeronimo-Aguilar P, Vargas-Rodríguez I, Cadena-Suárez AR, Sánchez-Garibay C, Pozo-Molina G, Méndez-Catalá CF, Cardenas-Aguayo MD, Diaz-Cintra S, Pacheco-Herrero M, Luna-Muñoz J, Soto-Rojas LO. Alzheimer's Disease: An Updated Overview of Its Genetics. Int J Mol Sci. 2023 Feb 13;24(4):3754. doi: 10.3390/ijms24043754. PMID: 36835161; PMCID: PMC9966419.
- Binda A, Murano C, Rivolta I. Innovative Therapies and Nanomedicine Applications for the Treatment of Alzheimer's Disease: A State-of-the-Art (2017-2020). Int J Nanomedicine. 2020 Aug 14;15:6113-6135. doi: 10.2147/IJN.S231480. PMID: 32884267; PMCID: PMC7434571.
- Bhatia S, Rawal R, Sharma P, Singh T, Singh M, Singh V. Mitochondrial Dysfunction in Alzheimer's Disease: Opportunities for Drug Development. Curr Neuropharmacol. 2022;20(4):675-692. doi: 10.2174/1570159X19666210517114016. PMID: 33998995; PMCID: PMC9878959.
- Bhole RP, Chikhale RV, Rathi KM. Current biomarkers and treatment strategies in Alzheimer disease: An overview and future perspectives. IBRO Neurosci Rep. 2023 Nov 30;16:8-42. doi: 10.1016/j.ibneur.2023.11.003. PMID: 38169888; PMCID: PMC10758887.
- Chancellor B, Duncan A, Chatterjee A. Art therapy for Alzheimer's disease and other dementias. J Alzheimers Dis. 2014;39(1):1-11. doi: 10.3233/JAD-131295. PMID: 24121964.
- Fatima G, Ashiquzzaman A, Kim SS, Kim YR, Kwon HS, Chung E. Vascular and glymphatic dysfunction as drivers of cognitive impairment in Alzheimer's disease: Insights from computational approaches. Neurobiol Dis. 2025 May;208:106877. doi: 10.1016/j.nbd.2025.106877. Epub 2025 Mar 17. PMID: 40107629.
- Gouras GK, Olsson TT, Hansson O. β-amyloid Peptides and Amyloid Plaques in Alzheimer's Disease, Neurotherapeutics, Volume 12, Issue 1, 2015, Pages 3-11, ISSN 1878-7479.
- Inan S, Wilson RP, Tükel Ç. IUPHAR review: From gut to brain: The role of gut dysbiosis, bacterial amyloids, and metabolic disease in Alzheimer's disease. Pharmacol Res. 2025 May;215:107693. doi: 10.1016/j.phrs.2025.107693. Epub 2025 Mar 12. PMID: 40086611.
- Jamerlan AM, An SSA, Hulme JP. Microbial diversity and fitness in the gut-brain axis: influences on developmental risk for Alzheimer's disease. Gut Microbes. 2025 Dec;17(1):2486518. doi: 10.1080/19490976.2025.2486518. Epub 2025 Apr 10. PMID: 40207973; PMCID: PMC11988266.
- Kassem, Lamyaa M., Ibrahim, Nada A., Farhana, S. Ayesha, Nanoparticle Therapy Is a Promising Approach in the Management and Prevention of Many Diseases: Does It Help in Curing Alzheimer Disease?, Journal of Nanotechnology, 2020, 8147080, 8 pages, 2020.
- Neațu M, Covaliu A, Ioniță I, Jugurt A, Davidescu EI, Popescu BO. Monoclonal Antibody Therapy in Alzheimer's Disease. Pharmaceutics. 2023 Dec 29;16(1):60. doi: 10.3390/pharmaceutics16010060. PMID: 38258071; PMCID: PMC11154277.
- Oeckl P, Mayer B, Bateman RJ, Day GS, Fox NC, Huey ED, Ibanez L, Ikeuchi T, Jucker M, Lee JH, Levin J, Llibre-Guerra JJ, Lopera F, McDade E, Morris JC, Niimi Y, Roh JH, Sánchez-Valle R, Schofield PR, Otto M; Dominantly Inherited Alzheimer Network. Early increase of the synaptic blood marker β-synuclein in asymptomatic autosomal dominant Alzheimer's disease. Alzheimers Dement. 2025 Apr;21(4):e70146. doi: 10.1002/alz.70146. PMID: 40207431; PMCID: PMC11982912.
- Perluigi M, Di Domenico F, Butterfield DA. Oxidative damage in neurodegeneration: roles in the pathogenesis and progression of Alzheimer disease. Physiol Rev. 2024 Jan 1;104(1):103-197. doi: 10.1152/physrev.00030.2022. PMID: 37843394; PMCID: PMC11281823.
- Reitz C, Pericak-Vance MA, Foroud T, Mayeux R. A global view of the genetic basis of Alzheimer disease. Nat Rev Neurol. 2023 May;19(5):261-277. doi: 10.1038/s41582-023-00789-z. Epub 2023 Apr 6. PMID: 37024647; PMCID: PMC10686263.
- Rollo J, Crawford J, Hardy J. A dynamical systems approach for multiscale synthesis of Alzheimer's pathogenesis. Neuron. 2023 Jul 19;111(14):2126-2139. doi: 10.1016/j.neuron.2023.04.018. Epub 2023 May 11. PMID: 37172582.
- Shajahan SR, Kumar S and Ramli MDC (2024) Unravelling the connection between COVID-19 and Alzheimer’s disease: a comprehensive review. Front. Aging Neurosci. 15:1274452. doi: 10.3389/fnagi.2023.1274452.
- Silva-Spínola, A.; Baldeiras, I.; Arrais, J.P.; Santana, I. The Road to Personalized Medicine in Alzheimer’s Disease: The Use of Artificial Intelligence. Biomedicines, 2022, 10, 315.
- Skaria AP. The economic and societal burden of Alzheimer disease: managed care considerations. Am J Manag Care. 2022 Sep;28(10 Suppl):S188-S196. doi: 10.37765/ajmc.2022.89236. PMID: 36197132.
- Vacchi E, Ruiz-Barrio I, Melli G. Tau biomarkers for neurodegenerative diseases: Current state and perspectives. Parkinsonism Relat Disord. 2025 May;134:107772. doi: 10.1016/j.parkreldis.2025.107772. Epub 2025 Mar 10. PMID: 40185651.
- Vecchio I, Sorrentino L, Paoletti A, Marra R, Arbitrio M. The State of The Art on Acetylcholinesterase Inhibitors in the Treatment of Alzheimer's Disease. J Cent Nerv Syst Dis. 2021 Jul 7;13:11795735211029113. doi: 10.1177/11795735211029113. PMID: 34285627; PMCID: PMC8267037.
- Vu M, Mangal R, Stead T, Lopez-Ortiz C, Ganti L. Impact of Alzheimer's Disease on Caregivers in the United States. Health Psychol Res. 2022 Aug 20;10(3):37454. doi: 10.52965/001c.37454. PMID: 35999976; PMCID: PMC9392839.
- Wegmann S, Biernat J, Mandelkow E. A current view on Tau protein phosphorylation in Alzheimer's disease, Current Opinion in Neurobiology, Volume 69, 2021, Pages 131-138, ISSN 0959-4388.
- Xiaobo Yang, Kai Yao, Mengqi Zhang, Wenbin Zhang, Hengbing Zu. New insight into the role of altered brain cholesterol metabolism in the pathogenesis of AD: A unifying cholesterol hypothesis and new therapeutic approach for AD, Brain Research Bulletin, Volume 224, 2025, ISSN 0361-9230,
https://www.who.int/news-room/fact-sheets/detail/dementia
https://www.alzheimer-forschung.de/alzheimer/wasistalzheimer/geschichte-der-alzheimer-krankheit/
https://www.nature.com/immersive/alzheimers-disease-history/index.html



Kommentar schreiben